焦亡作为心肌梗死(MI)后的关键病理过程之一,在心肌损伤中扮演着重要角色。巨噬细胞与经历焦亡的心肌细胞之间的相互作用,构成了心梗后抗焦亡治疗的重大障碍。现有的针对单一靶点的焦亡抑制剂,往往难以克服这一复杂的细胞间通信,导致其治疗效果不尽如人意。鉴于此,寻找更为高效的焦亡抑制策略,特别是那些能够有效干预巨噬细胞与焦亡心肌细胞之间互动的方法,成为提高心梗治疗成效的关键所在。
2024年10月10日,同济大学医学院李永勇研究员和上海市东方医院赵军教授团队在国际知名期刊《Biomaterials》在线发表了题为“Anti-pyroptosis biomimetic nanoplatform loading puerarin for myocardial infarction repair: From drug discovery to drug delivery”的研究论文。该文通过合成了一种抗焦亡仿生纳米平台(NM@PDA@PU),该平台以中性粒细胞膜(NM)包裹的聚多巴胺(PDA)纳米粒子为核心载体,用于靶向递送抗焦亡药物,为心肌梗死的有效治疗提供了新的策略。

值得一提的是,本研究采用了网络药理学方法,从临床广泛应用的中药成分中精心挑选出七种主要活性物质,并从中甄别出葛根素作为最具潜力的抗焦亡药物。该研究不仅揭示了葛根素对于巨噬细胞与焦亡心肌细胞间交互影响的机制,还通过体内及体外实验验证了葛根素的靶向给药方式能够有效地通过NLRP3-CASP1-IL-1β/IL-18信号通路抑制心肌细胞的焦亡,同时促进巨噬细胞向抗炎的M2表型转化,进而优化炎症微环境,打破巨噬细胞与焦亡心肌细胞之间的负面反馈循环,显著增强了抗焦亡的总体效果。
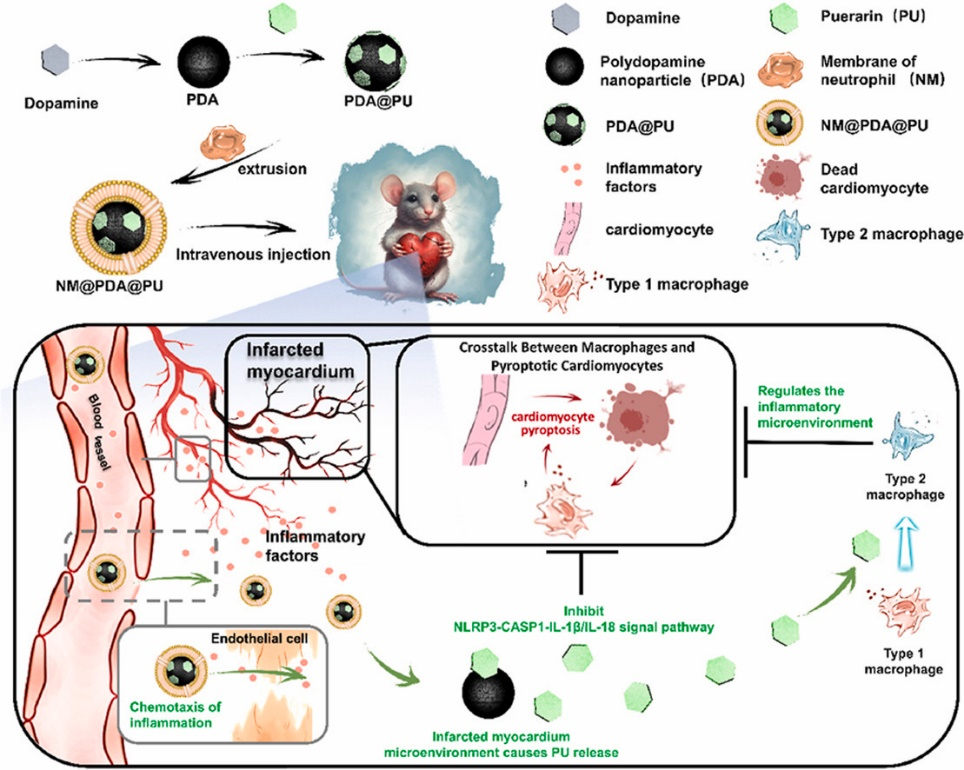
综上所述,NM@PDA@PU通过有效阻断M1巨噬细胞与焦亡心肌细胞间的不良互动,不仅强化了抗焦亡的效果,也为保护心肌细胞、提升心脏功能及防止心室重构提供了全新的治疗方案,为心肌梗死的有效治疗开辟了新路径。
在此研究中,作者使用近岸蛋白重组小鼠IFN-γ 蛋白(Novoprotein, Shanghai, China),工作浓度为50ng/ml培养24h诱导M1巨噬细胞极化,为高质量的实验结果助力。
实验步骤:
1、诱导RAW264.7向M1的极化:加入含有LPS(100ng/mL)和IFN-γ(50ng/ml)的新鲜培养基,37℃培养箱培养24h。
2、在培养24h小时后,用流式的方法检测极化后M1巨噬细胞标志蛋白的表达。
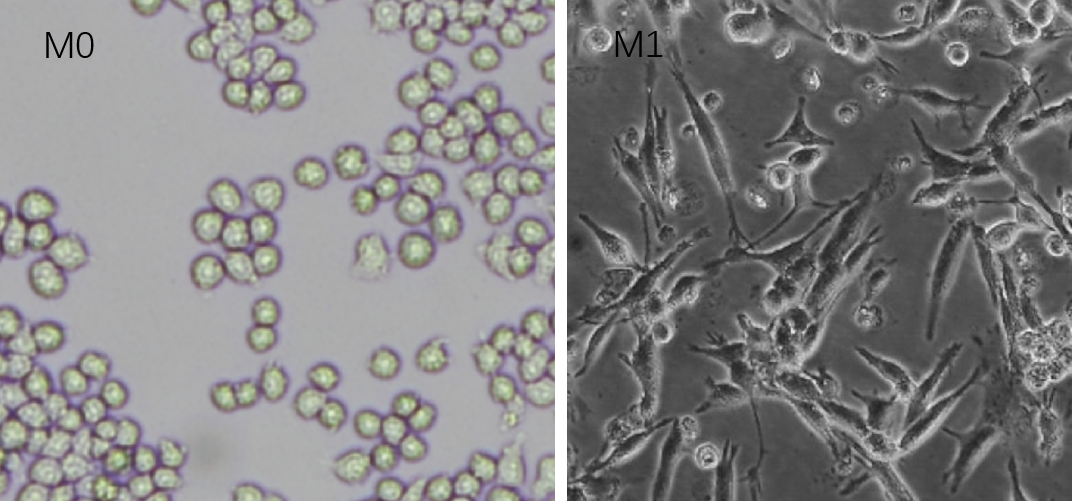
RAW264.7 Macrophages
近岸蛋白提供高活性重组IFN-γ蛋白,助力您的科研实验!
高活性重组IFN-γ蛋白(Cat.No.:C746)
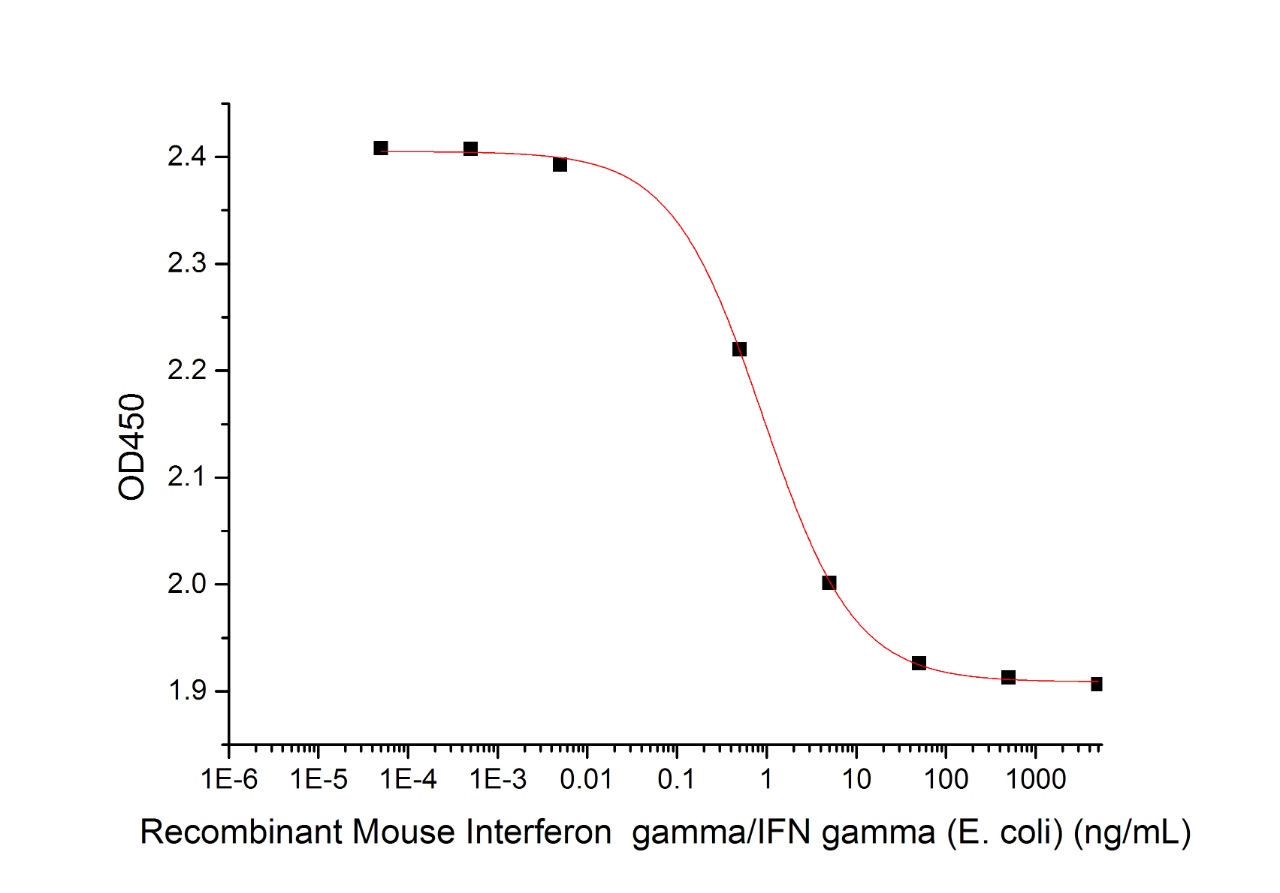
Determined by its ability to inhibit the proliferation of murine WEHI-279 cells. The expected ED50 is 1 ng/ml.
