植物激素是调节植物生长、发育和环境应激反应等关键方面的信号化合物。干旱、盐碱、高温、寒冷和洪涝等非生物胁迫对植物的生长和存活有着深远的影响。对这种胁迫的适应和耐受涉及到复杂的感知、信号和胁迫反应机制。
2022年5月6日,Nature reviews molecular cell biology(IF=94.4 2021年)杂志在线发表了美国科学院院士、中科院特聘研究员、美国加州大学圣地亚哥分校Julian Schroeder教授为通讯作者的题为“Plant hormone regulation of abiotic stress responses”的综述文章。

植物在不断变化的环境条件发展出复杂的机制来感知和响应外部压力。其中,非生物胁迫以各种形式出现,为了保护植物免受非生物胁迫负面影响,我们需要在分子水平上了解植物胁迫反应的机制。植物种中9种常见的植物激素:脱落酸(ABA)、生长素、油菜素内酯、细胞分裂素、乙烯、赤霉素、茉莉酸、水杨酸和独角金内酯,是众所周知的植物生长调节剂,本文首先列举了这些植物激素在非生物胁迫反应中最显著的作用。
百趣提供全面包含九大类植物激素的植物激素高通量检测方案,采用定量金标准-同位素内标法绝对定量,详细内容可点击链接查看:技术介绍|植物激素高通量靶标定量
随后作者主要围绕非生物胁迫(包括干旱、渗透胁迫和水涝)从植物如何感受胁迫、介导植物非生物胁迫反应激素依赖的基因调控机制、胁迫相关激素反应对种子萌发和开花时间的影响、ABA和生长素如何协调胁迫下的根生长、乙烯和赤霉素介导的植物对淹水反应的调节、ABA和非生物胁迫感应机制调节气孔开度等方面全面描述了植物激素和其他信号化合物如何调节植物对非生物胁迫的反应的研究现状。
渗透胁迫传感与信号转导
包括植物从外部土壤中吸收水分以及植物内部水分的转运均是由水势梯度决定的,例如水涝等低渗胁迫下会导致细胞肿胀,而干旱盐碱等高渗胁迫下则会导致植物萎蔫。植物已经进化出包括通过依赖ABA和不依赖ABA的途径调节细胞渗透浓度、气孔运动和植物发育等渗透胁迫适应机制。
1. 渗透和盐胁迫传感机制
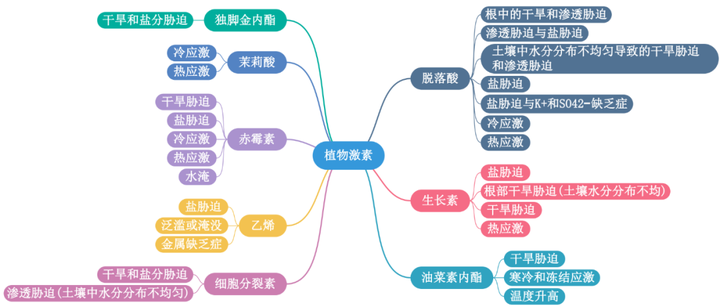
植物之所以能够感知膨压变化、细胞内溶质浓度的轻微变化以及渗透胁迫对细胞结构的机械作用,是因为钙信号在渗透胁迫中起到了关键作用,植物细胞内游离钙浓度([Ca2+]cyt)在受到渗透胁迫后的几秒钟内会迅速且瞬时地升高。早已有研究表明了机械敏感离子通道在渗透胁迫传感机制中的作用(图2a)。比如类似小导电的机械敏感通道(mechanosensitive channel of small conductance-like MSL)是细胞器低渗、花粉水合和萌发、根中的触摸反应和细胞膨大过程中由膜张力激活的非选择性离子通道;MID1-补充活动型钙渗透通道(mid1-complementing activity MCA)会被膜张力激活,进而介导根的低渗透休克和触觉感知;以及机械敏感离子通道PIEZO1(PZO1)是根尖机械转导所必需 ,可以介导拟南芥花粉管尖端的液泡管状形成;OSCA1(reduced hyperosmolality-induced[Ca2+]cyt increase 1)是一种潜在的渗透压感受器,最典型的特征是在高渗透压下激活Ca2+阳离子通道(图2b)。最近的研究表明钙响应型磷脂结合蛋白(Ca2+-responsive phospholipid-binding BONZAI BON)通过正向调节渗透胁迫诱导的[Ca2+]cyt增加、ABA积累和基因表达来介导高渗透胁迫耐受性,这些膜相关的钙响应性BON蛋白可能通过与质膜钙转运蛋白一起调节初始的[Ca2+]cyt升高而参与渗透感知和信号转导。
植物感知盐度并诱导快速而瞬时的[Ca2+]cyt升高,进而通过盐过度敏感的途径触发耐盐反应(图2c)。盐胁迫下,受体样激酶Feronia能够感知盐度引起的细胞壁缺陷,并引发细胞特异性的[Ca2+]cyt细胞信号以维持细胞壁的完整性。Feronia还可能通过与ABI2(protein phosphatase 2c(PP2C)ABA-insensitive 2)的相互作用来干扰ABA信号。
2. 渗透胁迫诱导ABA的生物合成
内源性ABA浓度在植物缺水后约2.5-6小时内会逐渐升高。由NCED3基因编码9-cis-epoxycatoteinoid dioxygenase会催化ABA从头合成的限速步骤,同样的,NCED3在叶绿体中的翻译后处理也有被报道能够调节ABA的积累。作为对根缺水的响应,水势信号参与了从根到冠的快速缺水信号,从而触发拟南芥叶片和气孔关闭中ABA的生物合成。在转录水平上,拟南芥NAC转录因子ATAF1被认为调节NCED3的表达,以促进ABA的积累(图2b)。
非生物胁迫下的基因调控
基因表达的变化介导了植物激素的许多作用。 早期的基因组技术表明,与非生物胁迫相关的ABA水平升高会改变数千个基因的mRNA水平,连同许多经典的ABA不敏感突变被定位到转录调节因子的发现,表明基因调控在非生物胁迫抗性中的重要作用。
1.ABA介导的转录调控与激素串扰
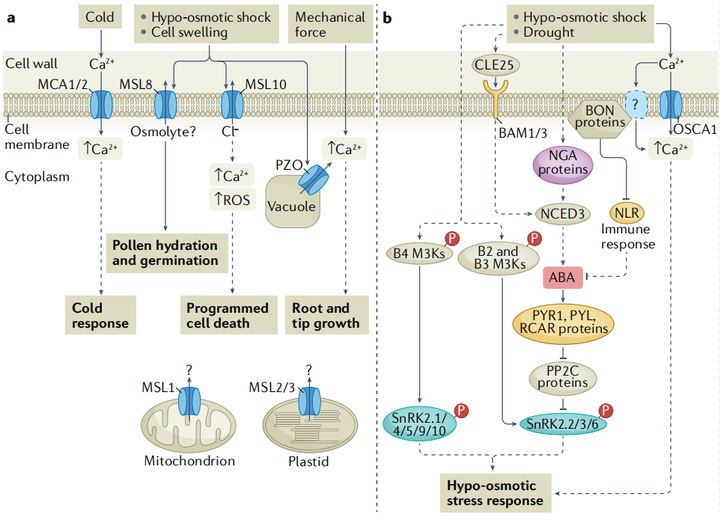
早期的研究发现,在干旱诱导基因的启动子中有一种保守的顺式作用调控元件,称为ABA反应元件(ABRE)。ABREs被碱性亮氨酸拉链型转录因子识别 (图3)。在ABA信号转导过程中,依赖于ABA的SnRK2型蛋白激酶直接磷酸化并激活AREBs/ABF(ABRE-binding proteins/ABRE-binding factors)和ABI5。一项利用染色质免疫沉淀和测序的开创性研究,在ABA反应期间分析了21个转录因子的全基因组结合位点,发现许多结合事件是动态的,并且多个转录因子可以针对同一基因。重要的是,ABA诱导的某些转录因子的结合与相邻ABRE位点的存在呈正相关,这表明一些转录因子可能与AREBs/ABF协同作用。
在没有非生物胁迫的情况下,不同的激素途径相互作用以控制植物生命活动的许多方面。比如在干旱胁迫方面,ABA诱导的干燥反应转录因子26(responsive to desiccation 26 RD26)抑制油菜素内酯诱导的基因的一个子集,同时,油菜素内酯激活的转录因子则会抑制RD26的表达,表明ABA信号和油菜素内酯信号之间的拮抗串扰有助于干旱胁迫反应(图3);细胞分裂素与ABA也同样存在串扰现象,SnRK2介导的A型拟南芥反应调节因子5(type-A arabidopsis response regulator 5 ARR5)的磷酸化是细胞分裂素信号传导的负调节因子,可促进其蛋白质稳定性,从而在干旱胁迫期间下调细胞分裂素反应。
2. 转录后非生物胁迫反应
转录后过程将基因调控的范围进一步扩展到转录控制之外,最近的研究揭示了这些机制在塑造ABA反应中的作用。最近发现一种ABA超敏突变体含有编码ABA超敏1(ABA hypersensitive 1 ABH1)mRNA帽结合蛋白的基因,使得mRNA处理和ABA信号之间建立了早期的联系,表明选择性的mRNA剪接会受到非生物胁迫的调节,并调节ABA的反应。根据近期的研究报道,mRNA衰变已成为导致非生物应激反应的额外机制。mRNA分子的降解是由mRNA脱帽介导的。在渗透胁迫期间,ABA非依赖的SnRK2蛋白激酶会使解帽激活物VARICOSE(VCS)磷酸化,从而导致某些转录物的不稳定。
非生物胁迫下的生长调控
植物激素调节植物生长发育的许多方面。最近的发现已经开始阐明它们如何控制植物生长和发育的不同策略,以响应非生物胁迫。
1.TOR与非生物胁迫的相互作用
雷帕霉素靶点(target of rapamycin TOR)是植物中一种重要的发育和代谢调节因子。ABA途径和TOR途径之间的相互调节来协调植物的生长和非生物胁迫反应。在非生物胁迫条件下,TOR使PYL/rcar ABA受体磷酸化,抑制ABA信号转导,促进生长,而ABA激活的SnRK2型蛋白激酶磷酸化TOR 1B调节相关蛋白(regulatory- associated protein of tor 1B RAPTOR1B),抑制TOR激酶活性进而抑制生长(图3)。
2.赤霉素、ABA和发芽的决定
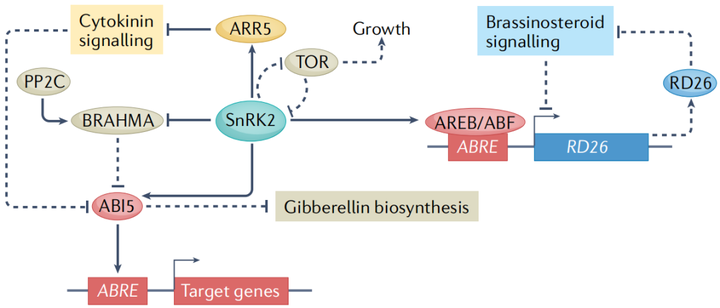
种子萌发的调节通过协调胚胎发育和出苗与环境条件来促进幼苗存活。两种相互竞争的激素信号通路赤霉素和ABA的平衡决定了发芽的与否。在种子成熟期间,转录因子网络包括ABA调节的转录因子ABI3、ABI4和ABI5,会诱导种子保持干燥和 ABA生物合成所需的基因,并抑制赤霉素生物合成基因。而植物触发种子打破种子休眠的诸如冷和光等环境信号,是通过将平衡转向赤霉素来实现的(图4A)。ABA和赤霉素之间的这种拮抗关系出现在它们各自途径的多个节点上,DELLA蛋白是植物特有的GRAS(GIBBERELLIN-INSENSITIVE,
REPRESSOR of ga1-3, SCARECROW)家族的成员。DELLA蛋白会抑制赤霉素反应,而赤霉素信号通过触发DELLA蛋白的蛋白酶体降解部分使它们失活。DELLA蛋白与ABI3和ABI5相互作用,这些蛋白复合体共同刺激SOMNUS的转录,SOMNUS是一种关键的休眠促进因子,能够激活ABA生物合成基因并抑制赤霉素生物合成基因。有趣的是,DELLA-ABI5复合体的作用被CBF表达的诱导物1(inducer of cbf expression 1 ICE1)抑制。ICE1的结合阻断了ABI5的DNA结合活性,这种相互作用受到赤霉素处理的刺激,可能是由于DELLA蛋白的降解,通过该机制,预先暴露于低温可能会促进发芽。
除了上述机制之外,ABI5的表达调控似乎是种子萌发过程中多种环境信号的主要调节点,光信号成分(elongated hypcotyl 5 HY5)响应光直接激活ABI5转录;DELLA蛋白RGL2通过增强ABI5的转录进一步促进ABA信号传导;根据最新报道,高盐度可能通过两种转录因子AGL21和RSM1在暴露于NaCl期间增强ABI5的表达进而抑制种子萌发。
3. 生长素、ABA与胁迫下的根系生长
虽然高浓度的外源ABA抑制了根的生长,但较低浓度的ABA会刺激初级根的生长。土壤中的水分分布是不均匀的,植物通过向水性,在一定程度上解决了这种情况。ABA缺乏突变体的向水性受到损害,对于向水性,蛋白激酶SnRK2.2是通过促进根伸长区的皮质细胞伸长使植物根系的差异生长 (图4B)。而低浓度的ABA通过AHA2(AUTOINHIBITEDH+-ATPASE 2)减弱pp2c对质外体H+外流的抑制,从而刺激初生根的生长。在高盐度环境中,侧根进入长时间的生长停滞,这需要内皮层ABA信号。根在远离高盐区域也表现出优先生长这一现象被称为--盐生(halotropism)。盐处理诱导生长素转运蛋白PIN2(PIN-FORMED 2)的内化,当根遇到纵向盐度梯度时,生长素在离盐源最远的根一侧积累,然后导致根弯曲。有趣的是,亲水性似乎并不是通过生长素的重新分配来起作用的,这表明亲盐性是一个与众不同的过程。
ABA还调节水分胁迫期间的根组织模式。内胚层ABA信号通过诱导microRNAs,miR165和miR166的表达来刺激木质部分化,miR165和miR166是维管发育的两个关键调节因子。ABA在木质部细胞中也发挥作用,在那里它激活几个促进木质部分化的维管相关NAC结构域(vascular-related NAC domain VND)转录因子的表达。
4. 赤霉素、ABA和乙烯调节非生物胁迫下的开花
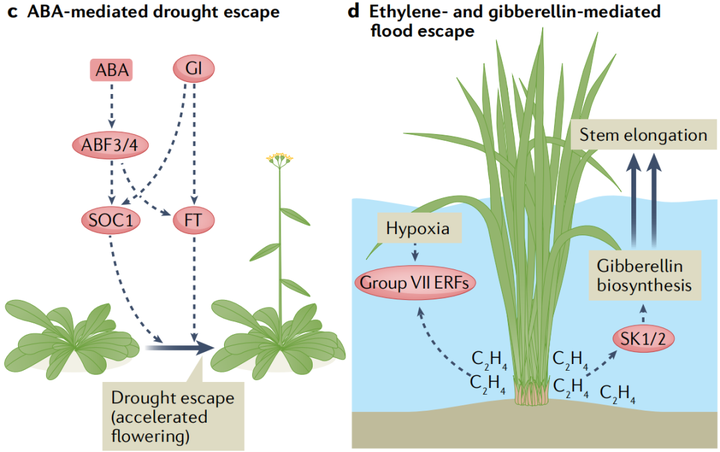
在长期干旱期间,许多植物会加速开花过程以在死亡前繁殖,这种反应被称为干旱逃逸(drought escape)。虽然ABA在开花转换过程中的确切作用目前尚不清楚。围绕干旱加速开花的现象,新出现的证据表明ABA信号具有积极的作用。在长日照条件下,ABA生物合成突变体的开花时间延迟,而对ABA敏感的pp2c三重突变体118的开花时间提前。至关重要的是,干旱胁迫放大了这种延迟,表明植物需要ABA来促进干旱逃逸。这种ABA在干旱诱导的开花中的积极作用需要依赖于光周期的核心开花调节蛋白GI(GIGANTEA)(图4c)。
与干旱相反,盐胁迫会导致拟南芥中依赖乙烯的开花时间延迟。盐胁迫通过诱导乙烯生物合成基因的表达导致乙烯积累。尽管潜在的机制尚不清楚,但乙烯干扰了赤霉素的信号传递,导致DELLA蛋白的积累,DELLA蛋白可以通过抑制开花刺激转录因子CONSTANS来推迟开花。此外,盐胁迫还通过诱导GI的降解来抑制开花。
5. 乙烯和赤霉素介导的水涝胁迫响应
植物组织的淹没阻碍了细胞对O2和CO2的获取,这会严重扰植物的乱新陈代谢。此外,水下气体扩散受限会导致乙烯在淹水的植物组织中积聚。长时间的淹水会导致低氧,这会激活一种保守的基因表达程序,支持植物在有限的氧气中存活。一些适应洪水的物种表现出一种逃生策略,即水下的嫩芽和树叶伸长到空中。对一种名为深水水稻(deepwater rice)的耐涝水稻品种的研究已经开始揭示乙烯和赤霉素信号是如何控制这种水下生长反应的。赤霉素通过促进节间生长来促进茎的伸长,这种关系在植物驯化过程中已经被利用。在深水水稻中,乙烯在淹没的茎和叶组织中积累,这种升高的乙烯浓度诱导ERF编码基因SNORKEL1和SNORKEL2的表达,这两个主要数量性状基因与深水水稻节间伸长有关。SNORKEL1和SNORKEL2可能通过诱导赤霉素的生物合成来刺激茎的伸长(图4d)。最近,另一个与节间伸长相关的基因被定位到赤霉素生物合成的关键基因SEMIDWARF1(SD1)。与更常见的携带SD1零等位基因的半矮秆水稻品种不同,深水水稻植株诱导淹没组织中SD1的表达。由此产生的赤霉素水平的增加与另一个称为节间伸长加速器1(accelerator of internode elongation 1 ACE1)的基因一起作用,促进了中间分生组织中的细胞分裂。
气孔运动的调节
叶表皮中保卫细胞形成的气孔孔可以吸收二氧化碳进行光合作用,以换取水分。为了优化植物的水分利用效率,保卫细胞感知和响应包括光、二氧化碳和干旱在内的几种非生物因素。
1.气孔对干旱的响应
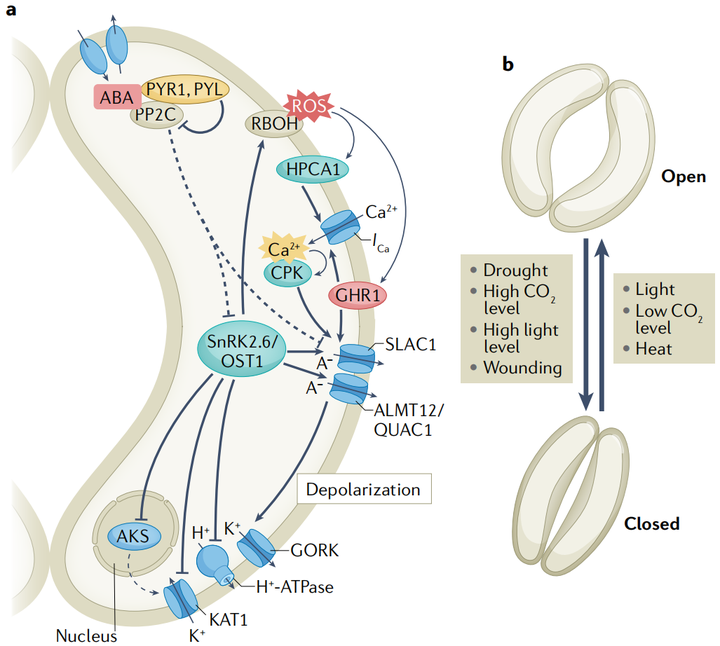
据报道,干旱胁迫会触发维管组织和保卫细胞的ABA合成。保卫细胞中的ABA信号调节质膜离子通道,触发负离子和K+的长期外流,导致保卫细胞缩小和气孔关闭。保卫细胞的负离子释放和随后的质膜去极化是由慢型和快型阴离子通道介导的。拟南芥保卫细胞中一个主要的慢型阴离子通道由慢阴离子通道相关1(slow anion channel- associated 1 SLAC1)编码, 阴离子通道触发的去极化继而通过电压依赖K+通道GORK诱导K+流出。蛋白激酶SnRK2.6是保卫细胞中ABA信号传导的主要正调节因子。SnRK2.6/OST1磷酸化并激活SLAC1和ALMT12 /QUAC1。A组pp2c蛋白作为负性ABA信号调节剂,不仅直接去磷酸化SnRK2.6/OST1 ,而且还使SLAC1失活(图5a)。
2. 保卫细胞中的非生物信号整合
保卫细胞可以感知和整合几种环境刺激(图5b)。其中,光和CO2是调节气孔开度的主要非生物刺激。蓝光和红光诱导气孔开放机制,使光合作用最大化。光诱导的气孔开放是由H+-ATPase酶激活和随后通过保卫细胞膜上的电压依赖的内向整流钾(K+in)通道吸收K+所介导的。ABA通过抑制H+-ATPase酶和通道中的K+来抑制光诱导的气孔开放。D组pp2c蛋白及其负调控因子小生长素上调RNAs(SAUR)也参与了拟南芥保卫细胞中H+-ATPase酶的调节。
ABA和其他激素之间的信号串扰有助于保卫细胞的非生物胁迫反应,据报道,过量的强光胁迫触发了局部和全株系统的气孔关闭,这可能是由NADPH氧化酶RBOHD与ABA、水杨酸和茉莉酸信号协同介导的。然而,黑暗和高二氧化碳浓度并不会导致拟南芥系统叶片的气孔关闭。在高温胁迫下,植物打开气孔,通过蒸腾作用为叶片降温。茉莉酸可以在高温和其他例如强光和机械损伤胁迫的组合中微调气孔。
研究小结
由于气候变化,干旱、盐分、高温和洪涝等非生物胁迫对植物的挑战越来越大。气候变化和非生物胁迫也会加剧植物病害。植物生物学的最新进展为植物如何感知和响应非生物胁迫提供了至关重要的新见解。虽然将这些发现转化为田间应用仍然具有挑战性,但本文对个体激素调控的非生物胁迫反应的深入理解,有可能为选育更具抗性的作物提供关键的见解。阐明控制这些性状的机制、基因和途径可以为应用和转化研究提供路线图,以提高或保护产量以响应非生物逆境。本文中讨论的许多进展都是在模式系统拟南芥中取得的。因此,需要深入研究,以确定作物中是否使用了类似或不同的机制。此外,很明显,特定的细胞类型有特定的激素信号通路和输出,因此改变细胞靶向或组织靶向的特征将需要研究这些细胞类型中的激素信号机制。此外,通过知识引导的作物新驯化来提高适应气候变化的野生品种的产量,为纳入有益的激素信号性状提供了一条重要的新途径。继续深入了解植物激素在非生物胁迫不同反应中的相互作用,将对开发非生物抗逆作物具有重要意义。
